Propiedades Periódicas de los Elementos Químicos
1.Radio atómico
2.Radio iónico
3.Potencial de ionización.
4.Afinidad electrónica
5.Electronegatividad y carácter metálico.
El estudio de la materia y de sus propiedades en el mundo occidental , empezó ya en la antigüedad , siglo V con los griegos . Se describía el mundo material como la combinación de cuatro elementos. Tierra , agua , aire , y fuego. A medida que se iban descubriendo nuevos elementos los químicos iban descubriendo analogías en sus propiedades. Existe por tanto una ley natural que relaciona los distintos elementos y los agrupa en función de sus propiedades.
DÖBERNIER en 1829 , hizo la primera clasificación de os elementos en triadas , conjunto de tres elementos de propiedades muy similares. El central tenía el peso atómico medio de los extremos de la triada.
Li Ca Cl S
Na Sr Br Se
K Ba I Te
 |
| Johann Wolfganf Döbernier |
NEWLAND , 1866 , formuló la ley de las octavas. En aquella época se hablaba de pesos atómicos y no de masas atómicas. Estos agrupamientos de ocho elementos permitieron definir las primeras propiedades periódicas.
 |
| John Al Newland |
MENDELEIEV Y MEYER , 1869 , tomando de partida los estudios anteriores establecieron la primera tabla de elementos basándose en:
- Colocar los elementos por orden creciente de masas atómicas.
- Agruparlos en función de sus propiedades . En el caso de Mendeleiev en columnas.
| Dimitri Mendeleiev |
Radio Atómico
El tamaño de un átomo no es invariable sino que depende del entorno inmediato en el que se encuentre, de su interacción con los átomos vecinos. Estimar el tamaño de los átomos es un poco complicado debido a la naturaleza difusa de la nube electrónica que rodea al núcleo y que varía según los factores ambientales. Se realizan las medidas sobre muestras de elementos puros no combinados químicamente y los datos así obtenidos son los tamaños relativos de los átomos.
El tamaño de un átomo no es invariable sino que depende del entorno inmediato en el que se encuentre, de su interacción con los átomos vecinos. Estimar el tamaño de los átomos es un poco complicado debido a la naturaleza difusa de la nube electrónica que rodea al núcleo y que varía según los factores ambientales. Se realizan las medidas sobre muestras de elementos puros no combinados químicamente y los datos así obtenidos son los tamaños relativos de los átomos.
Variación periódica del Radio atómico.
• Aumentan hacia abajo en un grupo (en cada nuevo periodo los electrones más ocupan niveles que están más alejados del núcleo, los orbitales de mayor energía son cada vez más grandes, y además, el efecto de apantallamiento hace que la carga efectiva aumente muy lentamente de un período a otro).
• Disminuyen a lo largo de un periodo (los nuevos electrones se encuentran en el mismo nivel del átomo, y tan cerca del núcleo como los demás del mismo nivel. El aumento de la carga del núcleo atrae con más fuerza los electrones y el átomo es más compacto).
• En el caso de los elementos de transición, las variaciones no son tan obvias ya que los electrones se añaden a una capa interior, pero todos ellos tienen radios atómicos inferiores a los de los elementos de los grupos precedentes IA y IIA. Los volúmenes atómicos van disminuyendo hasta que llega un momento en el que hay tantos electrones en la nueva capa que los apantallamientos mutuos y las repulsiones se hacen importantes, observándose un crecimiento paulatin o tras llegar a un mínimo.
Radio Iónico
La estructura y la estabilidad de los sólidos iónicos depende de manera crucial del tamaño de los iones. Éste determina tanto la energía de red del sólido como la forma en que los iones se empacan en el sólido. El tamaño de un ion depende de:
• Su carga nuclear.
• Número de electrones.
• Orbitales en los que residen los electrones de la capa exterior.
Variación periódica:
• Los iones positivos sencillos son siempre más pequeños que los átomos de los que derivan y, al aumentar la carga positiva, su tamaño disminuye.
• Los iones sencillos cargados negativamente son siempre mayores que los átomos de los que derivan. El tamaño aumenta con la carga negativa.
• Dentro de un grupo, las diferencias entre los radios atómicos e iónicos son muy parecidas. Para iones con la misma carga, el tamaño aumenta conforme bajamos por un grupo de la tabla periódica. Un aumento en el número cuántico principal del orbital ocupado más externo de un ion, aumenta también el tamaño del ion así
como el del átomo del que deriva.
Potencial de Ionización
1er Potencial de ionización: Energía necesaria para arrancar un e- de un átomo aislado en fase gaseosa en su estado fundamental y obtener un ion monopositivo gaseoso en su estado fundamental más un electrón sin energía cinética. Siempre se les asigna un valor positivo, por tratarse de una reacción endotérmica (abosorbe energía).
2do Potencial de ionización: Energía necesaria para arrancar a un ion monopositivo gaseoso en estado fundamental y obtener un ion dipositivo en las mismas condiciones mas un electrón sin energía cinética. Energía de ionización total para llegar a un ion determinado es la suma de los sucesivos potenciales de ionización.
Variación periódica:
• Dentro de una familia, el aumento del número de electrones tiende a reducir el potencial de ionización debido a los efectos combinados del tamaño y de efecto pantalla. Al descender en un grupo, se obtienen átomos más voluminosos en los que los electrones están menos retenidos, por lo que el potencial de ionización decrecerá.
• En un periodo tiende a aumentar al hacerlo el número atómico. En principio, la tendencia que cabria esperar es que al aumentar la carga nuclear efectiva y no aumentar apenas el radio atómico, la energía de ionización sea cada vez mayor.
• En cada segmento periódico, los gases nobles tienen las energías de ionización más elevadas. Estos gases son elementos muy estables y sólo los más pesados de ellos muestran alguna tendencia a unirse con elementos para dar compuestos.
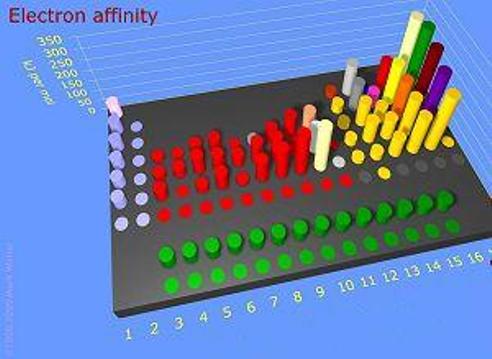
Afinidad Electrónica
Energía desprendida en un proceso en el que un determinado átomo neutro gaseoso en estado fundamental, capta un electrón para dar un ion mononegativo gaseoso en estado fundamental. Este proceso de captación de electrones suele ser favorable (la atracción nuclear compensa la repulsión electrónica). Las segundas, terceras, ... afinidades electrónicas son siempre energéticamente desfavorables. La energía total puesta en juego para pasar de un átomo neutro en estado fundamental y gaseoso a un ion negativo con n cargas es la suma de las afinidades electrónicas.
La variación de afinidad electrónica dentro del sistema periódico es similar a la variación del potencial de ionización, aunque es mucho menos periódica. A partir de estas dos propiedades se puede analizar hasta que punto un átomo neutro está satisfecho con su número de electrones. A mayor potencial de ionización y electroafinidad, mayor es la apetencia electrónica (electronegatividad) de la especie.
• Los elementos con las afinidades electrónicas más altas son los situados cerca del oxígeno, el flúor y el cloro.
Electronegatividad
La electronegatividad de un elemento mide su tendencia a atraer hacia sí electrones, cuando está químicamente combinado con otro átomo. Cuanto mayor sea, mayor será su capacidad para atraerlos. Pauling la definió como la capacidad de un átomo en una molécula para atraer electrones hacia así. Sus valores, basados en datos termoquímicos, han sido determinados en una escala arbitraria, denominada escala de Pauling, cuyo valor máximo es 4 que es el valor asignado al flúor, el elemento más electronegativo. El elemento menos electronegativo, el cesio, tiene una electronegatividad de 0,7. La electronegatividad de un átomo en una molécula está relacionada con su potencial de ionización y su electroafinidad. Un átomo con una afinidad electrónica muy negativa y un potencial de ionización elevado, atraerá electrones de otros átomos y además se resistirá a dejar ir sus electrones ante atracciones externas; será muy electronegativo.
Variación periódica:
• Las electronegatividades de los elementos representativos aumentan de izquierda a derecha a lo largo de los periodos y de abajo a arriba dentro de cada grupo.
• Las variaciones de electronegatividades de los elementos de transición no son tan regulares. En general, las energías de ionización y las electronegatividades son inferiores para los elementos de la zona inferior izquierda de la tabla periódica que para los de la zona superior derecha.
Carácter Metálico
Se entiende por metal un elemento con pocos electrones en su última capa ( 1 ó 2) y
excepcionalmente (3 ó 4) y gran tendencia a cederlos.
El no metal tendrá gran tendencia a la captación de electrones.
Por tanto a medida que descendemos en un grupo los electrones están “ más libres” , menos
atrapados por el campo de atracción del núcleo y el carácter metálico aumentará.
Al avanzar hacia la derecha en un periodo la afinidad electrónica al aumentar , hace que el
átomo tenga tendencia a captar electrones (mayor electronegatividad), y por tanto el
carácter metálico disminuirá.








buen trabajo chicos 94/100
ResponderEliminar